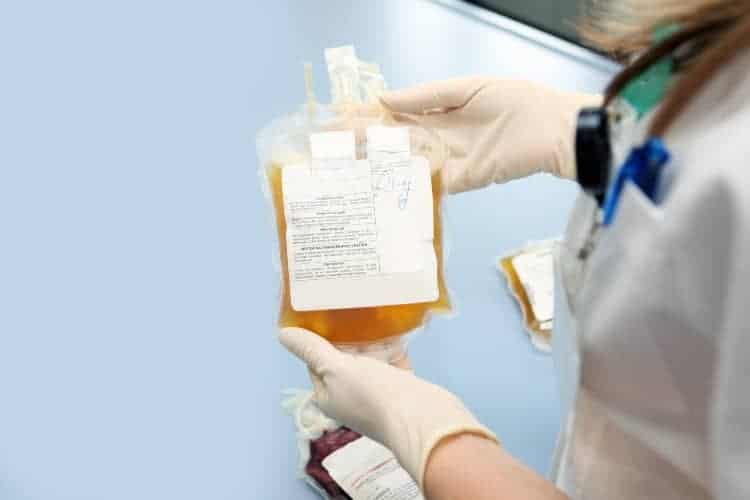
In den USA ist seit Ende August die Plasmatherapie bei Covid-19 per Notfallgenehmigung erlaubt. Eine systematische Übersichtsarbeit hat untersucht, ob die Plasmatherapie wirksam und sicher ist – und liefert damit eine wichtige Erfassung des aktuellen Wissensstandes.
Immer wieder werden Menschen, die nach einer Covid-19-Infektion genesen sind, zum Spenden von Blutplasma aufgerufen. Denn im Plasma befinden sich nach einer überstandenen Infektion meistens viele Antikörper gegen das neuartige Coronavirus SARS-CoV-2. Die gespendeten Antikörper und möglicherweise auch andere Abwehrstoffe könnten den Empfängerinnen und Empfängern gegen Covid-19 helfen.
Im Idealfall sollen sich die gespendeten Antikörper an die Coronaviren binden und diese unschädlich machen. Soweit die Theorie. Zumindest bei anderen viralen Infekten, wie etwa SARS (Schweres Akutes Respiratorisches Syndrom) und Influenza, hat sich der Einsatz von so genanntem Rekonvaleszenten-Plasma bereits bewährt. Es wird mittels Transfusion übertragen.
Ende August 2020 hat die amerikanische Zulassungsbehörde FDA (Food and Drug Administration) in den USA die Covid-19 Behandlung mit Plasma per Notfallgenehmigung gestattet. Anders als bei einer hürdenreichen Zulassung wurde hier nicht abgewartet, bis umfassende Tests mit eindeutigen Ergebnissen zu Wirksamkeit und Sicherheit vorlagen.
Bestätigen sich die Hoffnungen?
Was ist derzeit über die Wirksamkeit und die Sicherheit der Plasmatherapie bei Covid-19 bekannt? Dieser Frage ist ein Autorenteam rund um Vanessa Piechotta (Cochrane Haematology an der Klinik I für Innere Medizin, Uniklinik Köln) nachgegangen. Die 13 Forscherinnen und Forscher wollten wissen, ob die experimentelle Therapie die Virusinfektion kürzer und weniger schwer ausfallen lässt. Und: Wie sicher ist die Therapie mit frischem oder eingefrorenem Rekonvaleszenten-Plasma bei COVID-19? In die Übersichtsarbeit sind nach umfassender Suche die besten verfügbaren wissenschaftlichen Studien eingeflossen: Die 19 Studien umfassen 38.160 Teilnehmerinnen und Teilnehmern aus China, Italien, Mexiko und den USA, den Niederlanden, dem Irak und Iran. Alle wurden im Spital behandelt. Die meisten waren schwerkrank, und 36.081 von ihnen haben Rekonvaleszenten-Plasma erhalten.
Keine solide Einschätzung möglich
Die zusammenfassende Auswertung konnte allerdings keine definitiven Antworten hervorbringen. Möglicherweise bessern sich die Beschwerden der Patientinnen und Patienten ein wenig. Und vielleicht reduziert sich das Risiko, an Covid-19 zu sterben.
Das Autorenteam aus Köln kann allerdings nur wenig Vertrauen in diese Ergebnisse legen und betont deren Unsicherheit. Die zugrundeliegenden Studien waren nur schwer miteinander vergleichbar, etwa weil die Patientinnen und Patienten unterschiedliche Zusatzbehandlungen erhielten, diverse Vorerkrankungen hatten oder es eine große Spanne von Beobachtungszeiten gab.
Außerdem fehlte in den meisten Studien eine nicht mit Plasma behandelte Kontrollgruppe, sodass sich der Einfluss der neuartigen Therapie nicht eindeutig erkennen lässt. Nur zwei der 19 eingeschlossenen Studien waren randomisierte kontrollierte Studien. Das wäre grundsätzlich die optimale – weil wenig verzerrungsanfällige – Studienform, um die Wirksamkeit der Plasmatherapie zu belegen. Allerdings lassen auch beide RCTs viele Fragen offen. Etwa weil sie nur wenige Teilnehmerinnen und Teilnehmer umfassten und Sicherheitsdaten in der Kontrollgruppe fehlten.
Risiken unklar
Neben der Wirksamkeit hat die Übersichtsarbeit auch die Sicherheit der Plasma-Therapie hinterfragt. Wiederum konnte das Autorenteam keine sicheren Schlüsse ziehen. Denn unerwünschte Reaktionen wurden kaum bzw. nicht einheitlich erfasst. Außerdem blieb mangels Kontrollgruppen unklar, ob die berichteten schweren Nebenwirkungen wie allergische Reaktionen, Atemwegskomplikationen oder Tod tatsächlich in ursächlichem Zusammenhang mit der Plasmatherapie standen. Unsicher ist auch, ob es bei der Plasmatherapie häufiger zu Nebenwirkungen kommt und ob diese schwerwiegender sind als bei anderen Therapien.
Keine Studien zu Hyperimmunserum
Die Forscherinnen und Forscher haben auch nach Studien zur Covid-19-Therapie mit Hyperimmunserum gesucht. Das ist, stark vereinfacht, eine hoch konzentrierte und besonders aufwändige Form der Plasmatherapie. Doch zu dieser Behandlungsform gab es keine Studien: weder für die früheren Versionen, erschienen im Mai und Juli 2020, noch für das aktuelle Update. Dementsprechend sind keine Aussagen zu Wirksamkeit und Sicherheit zur Hyperimmunserum-Therapie möglich.
Lebendige Evidenz
Bei der Übersichtsarbeit handelt es sich übrigens um einen „Living Systematic Review”. Das heißt, dass das Autorenteam die Entwicklung der Studienlage laufend beobachtet und bei Bedarf rasch mit einem Update reagiert. Derzeit werden ca. 140 Studien zur Plasmatherapie bei Covid-19 durchgeführt, etwa die Hälfte sind randomisiert-kontrollierte Studien (Stand: September 2020). Vielleicht können diese nach ihrer Veröffentlichung nicht nur den prinzipiellen Nutzen und möglichen Schaden der Plasmatherapie bei Covid-19 endlich besser beleuchten. Interessant wäre auch zu wissen, welche Patientinnen und Patienten eher profitieren und wann der optimale Zeitpunkt des Therapiebeginns ist. Eine weitere Frage ist, ob die Plasmatherapie vorbeugend wirkt, zum Beispiel für Personen, die ein hohes Risiko für eine Ansteckung oder einen schweren Verlauf haben. Genau dieser Frage geht das Kölner Autorenteam zur Zeit in einer separaten Arbeit nach.
„Voreiligen Interpretationen entgegenwirken“
Vanessa Piechotta ist wissenschaftliche Mitarbeiterin und Managing Editor bei Cochrane Haematology (haematology.cochrane.org) an der Uniklinik Köln. Die Gesundheits- und Ernährungswissenschaftlerin absolviert zur Zeit ihren PhD und ist federführend beim Living Systematic Review zur Plasmatherapie bei Covid-19.
Die US-amerikanische Arzneimittelbehörde, kurz FDA, hat eine Notfallgenehmigung erteilt. Das heißt, die Plasmatherapie darf seit August in den USA breiter eingesetzt werden ohne die üblichen Wirksamkeits- und Sicherheitsprüfungen. Steht das Einklang mit den Ergebnissen des Living Systematic Review?
Die von uns identifizierte und bewertete Evidenz lässt noch keine eindeutigen Schlüsse auf die Wirksamkeit oder Sicherheit der Plasmatherapie zu. Die Notfallgenehmigung beruht auf einer so genannten Expanded-Access-Studie aus den USA mit über 35.000 Patientinnen und Patienten. Das ist eine Studienform, bei der Schwerstkranke eine Therapie ohne Zulassung erhalten, nachdem etablierte Behandlungen versagt haben – in der Hoffnung, ihr Leben zu retten. Diese Expanded-Access-Studie hatte das Ziel, die Sicherheit der Plasmatherapie zu bewerten – im Fokus standen schwere unerwünschte Ereignisse innerhalb von vier Stunden nach der Transfusion. Zu berücksichtigen ist hier allerdings, dass diese Studie nicht kontrolliert ist. Es gab also keine Vergleichsgruppe von Patientinnen und Patienten, die keine Plasmatherapie erhalten haben. Damit kann die Sicherheit der Therapie nicht oder nicht vollständig bewertet werden. Ebenfalls wurde die Studie nicht dafür ausgerichtet, um die Wirksamkeit der Plasmatherapie zu beurteilen. Die Aussage, dass die Sterblichkeit durch die Therapie mit Rekonvaleszenten-Plasma reduziert werden kann, sollte daher mit absoluter Vorsicht interpretiert werden. Wir können dies zurzeit weder bestätigen noch ausschließen.
Sie haben bereits bei mehreren systematischen Übersichtsarbeiten mitgewirkt. War diese Übersichtsarbeit Routine?
Ja und nein – wir haben uns natürlich wie immer durchgehend an die Cochrane-Standards gehalten. Das Besondere an Living Reviews ist, dass sie mit ihren raschen Aktualisierungen auf rasante Entwicklungen und Fortschritte reagieren – wie es momentan in der COVID-19-Forschung notwendig ist.
Was hat sich im Vergleich zu den ersten beiden Version verändert?
Wir hatten zu Beginn sehr breite Einschlusskriterien. In der ersten Version konnten wir beispielsweise nur Fallserien und Fallberichte einschließen. Eigentlich wollten wir die Einschlusskriterien strikter fassen, sobald RCTs verfügbar sind. Dennoch haben wir uns auch in der aktuellen Version bewusst dafür entschieden, neben den inzwischen vorhandenen RCTs andere Studiendesigns weiterhin einzuschließen. Denn die beiden RCTs allein liefern keine aussagekräftige Evidenz zur Wirksamkeit und Sicherheit.
War beim Arbeitsprozess etwas überraschend oder außergewöhnlich?
Beispielsweise sind wir uns bei einer Studie auch nach zahlreichen Diskussionen immer noch nicht sicher, um welchen Studientyp es sich handelt. Die Ursache für Unklarheiten ist zum Beispiel eine mangelhaft berichtete Methodik oder fehlende Begutachtungsprozesse der Primärstudien bei den Vorab-Veröffentlichungen. Wir diskutieren auch fortlaufend, ob die Studien einheitlich genug sind, um sie zu statistisch zusammenzufassen, sodass die Ergebnisse noch aussagekräftig sind. Zum Beispiel sind wir unsicher, ob man Studienergebnisse zu stark unterschiedlicher Krankheitsdauer für eine Metaanalyse „in einen Topf werfen“ sollte. Wir sind da wohl deutlich kritischer als andere Studienteams, die rechnerisch zusammenfasst haben, was man aus unserer Sicht besser getrennt betrachten sollte. Das kann zu Fehlinterpretationen führen.
Warum kam es so rasch zu einem Update?
Unser Ziel ist, dass der Review immer den aktuellsten Kenntnisstand widerspiegelt. Schon als wir das letzte Update im Juli veröffentlicht haben, gab es noch über 100 laufende Studien. Einige davon sind bereits abgeschlossen oder wurden frühzeitig abgebrochen, und laufend gibt es Veröffentlichungen neuer Daten. Dadurch wurde das Update jetzt schon notwendig. Das nächste folgt vielleicht gegen Ende 2020.
Welchen Beitrag kann das Cochrane-Netzwerk zur Bewältigung der Pandemie leisten
Als unabhängiges Netzwerk von Forscherinnen und Forschern mit sehr hohen Qualitätsstandards stellt Cochrane verlässliche Evidenz für Politik, Bevölkerung, Forschung, Gesundheitspersonal und natürlich Patientinnen und Patienten zur Verfügung. Unser Ziel: die weltweite Evidenz systematisch zusammenzufassen und vor allem kritisch zu bewerten, um eine vertrauenswürdige Quelle bereitzustellen und voreiligen Interpretationen entgegenzuwirken.

Text: Julia Harlfinger, Mitarbeiterin von Cochrane Österreich

Im Interview: Vanessa Piechotta, Autorin der „lebendigen“ Übersichtsarbeit
Quellen
Chai KL, Valk SJ, Piechotta V, Kimber C, Monsef I, Doree C, Wood EM, Lamikanra AA, Roberts DJ, McQuilten Z, So-Osman C, Estcourt LJ, Skoetz N. Convalescent plasma or hyperimmune immunoglobulin for people with COVID‐19: a living systematic review. Cochrane Database of Systematic Reviews 2020, Issue 10. Art. No.: CD013600. DOI: 10.1002/14651858.CD013600.pub3. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013600.pub3/full
UpToDate (2020):
Coronavirus disease 2019 (COVID-19): Convalescent plasma and hyperimmune globulin
https://www.uptodate.com/contents/coronavirus-disease-2019-covid-19-convalescent-plasma-and-hyperimmune-globulin
abgerufen am 22-08-2020
UpToDate (2020):
Coronavirus disease 2019 (COVID-19): Management in hospitalized adults
https://www.uptodate.com/contents/coronavirus-disease-2019-covid-19-management-in-hospitalized-adults
abgerufen am 22-08-2020
Federal Drug Administration FDA (2020):
Recommendations for Investigational COVID-19 Convalescent Plasma
https://www.fda.gov/vaccines-blood-biologics/investigational-new-drug-ind-or-device-exemption-ide-process-cber/recommendations-investigational-covid-19-convalescent-plasma
abgerufen am 24-08-2020
Joyner MJ, Senefeld JW, Klassen SA, Mills JR, Johnson PW, Theel ES, Wiggins CC, Bruno KA, Klompas AM, Lesser ER, Kunze KL, Sexton MA, Diaz Soto JC, Baker SE, Shepherd JRA, van Helmond N, van Buskirk CM, Winters JL, Stubbs JR, Rea RF, Hodge DO, Herasevich V, Whelan ER, Clayburn AJ, Larson KF, Ripoll JG, Andersen KJ, Buras MR, Vogt MNP, Dennis JJ, Regimbal RJ, Bauer PR, Blair JE, Paneth NS, Fairweather D, Wright RS, Carter RE, Casadevall A. Effect of Convalescent Plasma on Mortality among Hospitalized Patients with COVID-19: Initial Three-Month Experience. medRxiv [Preprint]. 2020 Aug 12:2020.08.12.20169359. doi: 10.1101/2020.08.12.20169359. PMID: 32817978; PMCID: PMC7430623. https://pubmed.ncbi.nlm.nih.gov/32817978/