Aus einer Fülle von Therapiemöglichkeiten die beste zu wählen ist schwierig für ÄrztInnen, aber auch für EntwicklerInnen von medizinischen Leitlinien. Hilfestellung können sogenannte Netzwerkmetaanalysen innerhalb systematischer Übersichtsarbeiten geben.
Systematische Übersichtsarbeiten fassen vorhandene klinische Studien zu einer Fragestellung kritisch zusammen und haben damit zentrale Bedeutung für die Patientenversorgung, aber auch für die Gesundheitspolitik. Ein wichtiger Teil von systematischen Übersichtsarbeiten sind sogenannte Metaanalysen. Diese dienen dazu, die einzelnen Ergebnisse aus mehreren voneinander unabhängigen Studien statistisch zusammenzufassen und die Aussagekraft gegenüber Einzelstudien zu erhöhen.
Wurde z. B. in mehreren klinischen Studien die Wirkung der beiden Antidepressiva A und B miteinander verglichen, können einzelne Studienergebnisse widersprüchlich sein. ÄrztInnen, aber auch EntscheidungsträgerInnen in der Gesundheitsversorgung stehen dann vor der Frage, auf welches Studienergebnis sie ihre Entscheidung stützen sollen. Metaanalysen können hier Klarheit schaffen, indem sie aus den Ergebnissen der Einzelstudien ein studienübergreifendes Gesamtergebnis berechnen.
Was ist die beste Therapie, wenn mehr als zwei zur Auswahl stehen?
In konventionellen Metaanalysen werden jeweils nur zwei Therapieoptionen miteinander verglichen, man spricht deshalb von paarweisen Metaanalysen. Allerdings gibt es häufig mehr als zwei Therapieoptionen. Kommen für einen Patienten z. B. drei unterschiedliche Antidepressiva A, B oder C in Frage, ist die Wahl der besten Therapie schwierig. Es ist nötig, alle Optionen miteinander zu vergleichen. Doch oft gibt es keine Studien in denen mehrere Therapien miteinander direkt verglichen werden.
Eine Netzwerkmetaanalyse (NMA) ermöglicht es, mehr als zwei Therapieoptionen oder „Interventionen“ miteinander zu vergleichen. Sie ist eine Erweiterung der konventionellen paarweisen Metaanalyse. Eine NMA schätzt die Wirkung aller relevanten Interventionen basierend auf der gesamten Evidenz zu den vorhandenen Therapieoptionen. Sie lässt die Erstellung einer Rangliste von der „besten” bis zur „schlechtesten” Intervention zu. Dabei wird sowohl direkte Evidenz verwendet, d. h. Evidenz aus Studien, die zwei Interventionen direkt miteinander vergleichen, als auch indirekte Evidenz, d. h. Evidenz aus Vergleichen, die nicht unmittelbar durchgeführt wurden. Gibt es beispielsweise zwei Studien, die jeweils Antidepressivum A oder B mit einem Placebo vergleichen, kann die relative Wirksamkeit von A verglichen mit B über den gemeinsamen Vergleich mit Placebo indirekt geschätzt werden.
Therapieoptionen als Spinnennetz darstellen
Grafisch kann man sich ein solches Netzwerk wie ein Spinnennetz vorstellen, bei dem die Knotenpunkte die einzelnen Interventionen und die Fäden die durchgeführten Studien darstellen, in denen direkte Vergleiche zwischen zwei Interventionen vorgenommen wurden. Die folgende Abbildung zeigt ein Netzwerk mit den vier Interventionen A, B, C und D. Es gibt direkte Evidenz für alle Vergleiche außer dem zwischen A und C:
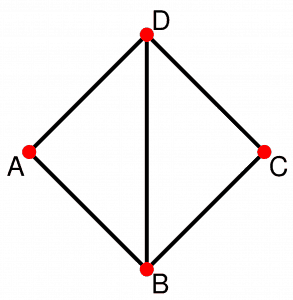
Den indirekten Vergleich A – C kann man als einen Mittelwert über die beiden Pfade von A nach C über B (also A – B – C) bzw. über D (also A – D – C) berechnen. In symbolischer Schreibweise lautet das
A – C = [(A – B) + (B – C)]/2 + [(A – D) + (D – C)]/2,
wobei z. B. A – B die Differenz der Behandlungseffekte von A und B bezeichnet. Doch strenggenommen gilt dies nur, wenn alle Vergleiche gleich stark gewichtet werden.
Ein reales Beispiel zu einer NMA ist der Vergleich von zwölf Antidepressiva der zweiten Generation, der von dem Psychiater Andrea Cipriani und seinen Kollegen im Jahr 2009 durchgeführt wurde. Insgesamt wurden 117 randomisierte klinische Studien mit über 25.000 Patienten eingeschlossen:
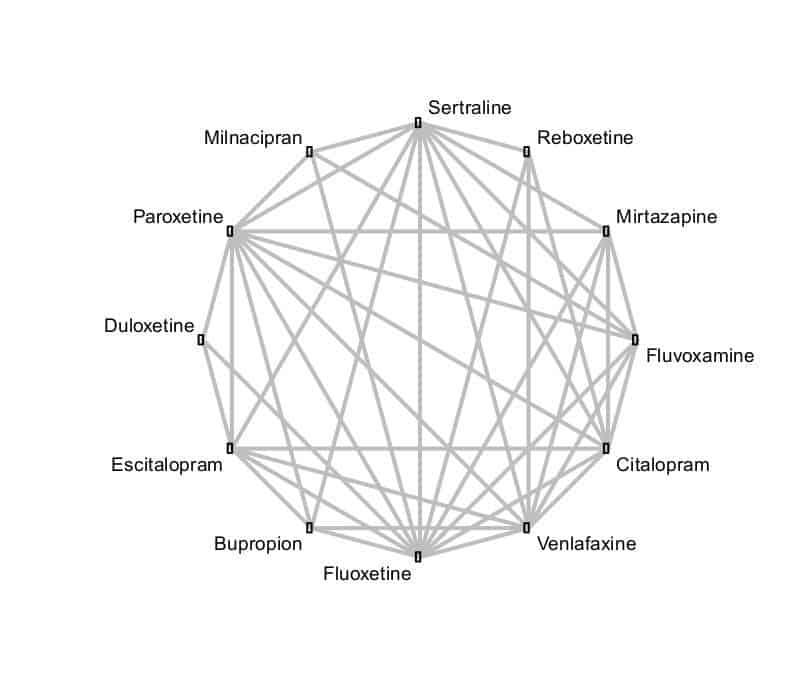
Die Methodik der NMA gewinnt mehr und mehr an Bedeutung und ist in der englischsprachigen Literatur auch bekannt als „Mixed Treatment Meta-Analysis” oder „Multiple Treatment Meta-Analysis”.
Ohne StatistikerInnen keine Netzwerkmetaanalyse
Die mathematischen Verfahren zur Erstellung von NMAs sind im Allgemeinen viel komplexer als die vergleichsweise einfachen Methoden der paarweisen Metaanalyse und erfordern statistisches Fachwissen. Wer eine Standard-NMA adäquat durchführen möchte, arbeitet unter folgenden Annahmen:
- Ähnlichkeitsannahme: Alle eingeschlossenen Studien sind vergleichbar, was den Studienaufbau angeht (z. B. nur randomisierte kontrollierte Studien), und wurden mit PatientInnen durchgeführt, die ähnliche Charakteristika aufwiesen (z. B. ähnliches Alter oder sonstige soziodemographische Daten). Nur so kann das zusammengefasste Ergebnis sinnvoll interpretiert und auf zukünftige PatientInnen übertragen werden.
- Homogenitätsannahme: In den jeweiligen paarweisen Vergleichen liegen keine bedeutenden Unterschiede vor, d. h. das Ausmaß, inwieweit sich die Ergebnisse der in die paarweisen Metaanalysen eingeflossenen Studien unterscheiden, ist mit dem Zufall vereinbar.
- Konsistenzannahme: Zwischen direkter und indirekter Evidenz liegen keine bedeutsamen Widersprüche vor.
Diese Annahmen sind aufgrund mangelnder Datenlage häufig nicht ausreichend überprüfbar und werden, auch wenn verfügbar, oft nicht routinemäßig untersucht. Daher kann den Ergebnissen einer NMA oft nur bedingt getraut werden. So liefern z. B. größere Netzwerke mehr Evidenz, haben aber auch mehr Potenzial für Heterogenität und Inkonsistenz.
Bewertung der Qualität einer NMA
NMAs sind eine bedeutende Weiterentwicklung konventioneller Metaanalysen und ermöglichen die Schätzung von Effekten für den Vergleich von Interventionen, auch wenn es hierzu keine direkte Evidenz gibt. Dies ist auch für die EntwicklerInnen von klinischen Leitlinien wichtig, die auf der Suche nach der besten Evidenz für ihre Fragestellung sind.
Aufgrund einer ständig wachsenden Zahl an Behandlungsmöglichkeiten zieht auch die Weltgesundheitsorganisation (WHO) NMAs zur Evidenzsynthese für die Erstellung ihrer Leitlinien heran, beispielsweise zur HIV-Prävention, Diagnose und Behandlung oder zur Früherkennung und Behandlung chronischer Hepatitis C.
Auch Cochrane Reviews enthalten immer häufiger NMAs zur Beantwortung von Fragestellungen, wie beispielsweise zu Interventionen, die die Abstoßung von Lebertransplantaten verhindern oder zur Behandlung von rheumatoider Arthritis.
Auch wenn NMAs immer häufiger verwendet werden, sollte man diese stets mit Vorsicht interpretieren, denn Ergebnisse aus NMAs sind im Vergleich zu adäquaten paarweisen Metaanalysen im Allgemeinen weniger vertrauenswürdig. Als Hilfestellung können Checklisten zur Bewertung von NMAs herangezogen werden. Es gibt auch eine PRISMA-Checkliste zur Berichterstattung von systematischen Übersichtsarbeiten, die eine NMA enthalten. Wer noch tiefer in die vielfältige Methodik der NMA eintauchen will, sei an einen aktuellen Methodenreview von Orestis Efthimiou und KollegInnen verwiesen.
Text: Harriet Sommer, Gerta Rücker und Valérie Labonté



